เทโลเมียร์ เพื่อเป็นแนวทางการรักษาที่เหมาะสม ในการชะลอ และป้องกันการหดสั้นลงของเทโลเมียร์ได้อย่างมีประสิทธิภาพ เช่นการปรับเปลี่ยนพฤติกรรมการนอน การออกกำลังกาย การรักษาระดับความเครียด รวมถึงการรับสารอาหารต่างๆ อีกด้วย
เทโลเมียร์ (Telomere) คือส่วนที่อยู่ปลายสุดของโครโมโซม (Chromosome) ทำหน้าที่ป้องกันไม่ให้ข้อมูลรหัสพันธุกรรมถูกทำลายไประหว่างการแบ่งเซลล์ โครงสร้างของโครโมโซมถูกค้นพบโดย Hermann Muller และ Barbara McClintock จากการศึกษาในแมลงหวี่ และ ข้าวโพดตามลำดับ พบว่ามีโครงสร้างพิเศษที่ส่วนปลายของโครโมโซมทำหน้าที่ปกป้องปลายโครโมโซม เพื่อไม่ให้เซลล์จดจำว่าเป็นส่วนของดีเอ็นเอ (DNA) ที่เสียหาย โดยป้องกันการเชื่อมกันใหม่อย่างผิดปรกติ หรือการย่อยสลายของปลายสายโครโมโซม ในปี 2009 Elizabeth Blackburn, Carol Greider และ Jack Szostak ได้รับรางวัลโนเบลสาขา Physiology or Medicine จากการค้นพบกระบวนการปกป้องโครโมโซมโดยเทโลเมียร์และเทโลมีเรส (Telomerase) ทำให้เกิดงานวิจัยในการศึกษามากมายอย่างจริงจังตามมา
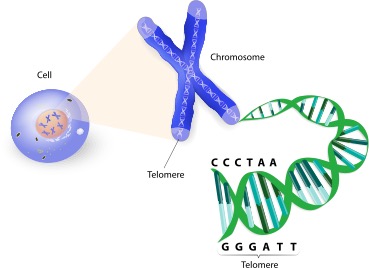
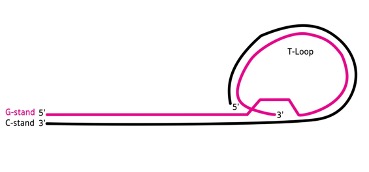
โครงสร้างของเทโลเมียร์เป็นส่วนลำดับเบสที่ไม่มีความหมายในการแปลรหัสที่มีลำดับเบสที่ซ้ำ ๆ เป็นชุด ๆ กันเช่น “TTAGGG” ซึ่งเป็นลำดับเบสที่อยู่ส่วนปลายของโครโมโซมในกลุ่มสัตว์ที่มีกระดูกสันหลังรวมถึงในมนุษย์ ซึ่งมีความยาวได้ตั้งแต่หลักหลายร้อยถึงหลายพันซ้ำ สายฝั่งของเทโลเมียร์ที่มีลำดับเบส G สายเดี่ยวหรือเรียกว่าสาย 3 ไพร์ม ที่ยื่นออกมา จะพับกลับเป็นวงขนาดใหญ่เรียกว่า Telomere loop หรือ T-loop โดยโครงสร้างนี้คล้ายคลึงกับลวดหนีบกระดาษ และมีกลุ่มของโปรตีนซึ่งจับอย่างจำเพาะเจาะจงกับลำเบส TTAGGG ของเทโลเมียร์ เพื่อรักษาความเสถียรของปลายสายเทโลเมียร์
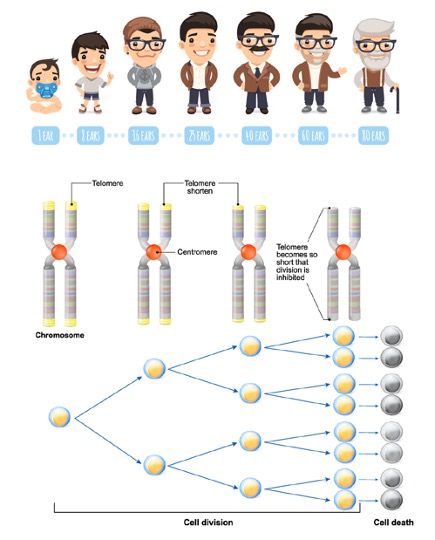
จากข้อจำกัดในการเพิ่มจำนวนของดีเอ็นเอซึ่งจะมีส่วนปลายขาดหายไปทุก ๆ ครั้งที่มีการเพิ่มจำนวน “End replication problem” ดังที่ Olovnikov ได้อธิบายการทำงานของเอนไซม์ DNA polymerase สังเคราะห์สายดีเอ็นเอ เหมือนกับรถไฟที่วิ่งบนรางโดยเปรียบตัวรถไฟเทียบกับเอนไซม์ และ รางรถไฟคือสายดีเอ็นเอ โดยรถไฟ (DNA polymerase) ไม่สามารถสร้างสายดีเอ็นเอ (ราง) เริ่มแรกได้เนื่องจากมีส่วนของรางที่อยู่ใต้ตัวรถไฟพอดี ทำให้ลำดับเบสที่มีความสำคัญคือยีนมีโอกาสหายไปเรื่อย ๆ ในทุก ๆ การแบ่งเซลล์ ดังนั้นลำดับเบสซ้ำที่ไม่มีความหมายของเทโลเมียร์ที่ส่วนปลายของโครโมโซม จึงมีความสำคัญโดยทำหน้าที่เป็นบัฟเฟอร์ป้องกัน ส่วนที่เป็นข้อมูลสำคัญในการทำงานของเซลล์ คาดว่าเทโลเมียร์จะหดสั้นลงเรื่อย ๆ ประมาณ 30-200 คู่เบส ในทุก ๆ รอบของการแบ่งเซลล์ และ ความยาวของเทโลเมียร์มีความสำคัญในการกำหนดความสามารถในการแบ่งเซลล์ของเซลล์ จากที่ทราบแล้วว่าปลายโครโมโซมในส่วนของเทโลเมียร์นั้นจะสั้นลงเรื่อย ๆ ทุก ๆ ครั้งที่มีเซลล์จะมีการแบ่งตัว เมื่อความยาวของเทโลเมียร์นั้นสั้นจนถึงระดับที่ถูกกำหนดไว้ เซลล์จะหยุดการแบ่งตัวไปตลอด (Senescence) หรือ เซลล์จะกระตุ้นให้เกิดการตายของเซลล์ด้วยตนเอง (Apoptosis) เหตุการณ์ดังกล่าวนี้เรียกว่า ข้อจำกัดของเฮฟลิก โดย เทโลเมอเรส (Telomerase) เป็นเอนไซม์ที่แก้ปัญหาของข้อจำกัดข้างต้น โดยทำหน้าที่ต่อเติมความยาวเทโลเมียร์ ในสภาวะปกติเทโลเมอเรสทำหน้าที่ในช่วงแรก ๆ ของการพัฒนาตัวอ่อนแรกเริ่มและในสเต็มเซลล์ของผู้ใหญ่ นอกจากนั้นเทโลเมอเรสยังสามารถแสดงออกและทำงานในสภาวะที่ผิดปกติเช่นกัน ตัวอย่างเช่น ในเซลล์มะเร็ง โดยทำให้เซลล์มะเร็งคงความสามารถในการเพิ่มจำนวนได้เป็นจำนวนมาก แต่ในเซลล์ปกตินั้นจะผลิตเทโลเมอเรสในปริมาณน้อยมาก ๆ หรือไม่ผลิตเลย
อนุมูลอิสระ (Oxygen free radical) เช่น O–2 , H2O2 และ Nitric oxide (NO) เกิดขึ้นจากกระบวนการเผาผลาญของร่างกาย โดยอาศัยออกซิเจนเกิดขึ้นที่ ไมโทคอนเดรีย (Mitochondria) ซึ่งเป็นออร์กาแนลล์ที่รับผิดชอบในการสร้างพลังงานให้กับเซลล์ อนุมูลอิสระบางชนิดมีประโยชน์ในการทำลายเชื้อโรคและสิ่งแปลกปลอม อย่างไรก็ตามอนุมูลอิสระยังสามารถจับกับพันธะเคมีของ ดีเอ็นเอ โปรตีน และ ไขมันภายในเซลล์ และขโมยอิเล็คตรอนของสารดังกล่าวเพื่อให้โมเลกุลเกิดความเสถียร เป็นผลให้ให้สารที่ถูกโขมยอิเล็คตรอนเกิดความไม่เสถียรแทน ทำให้เกิดการโขมยอิเล็คตรอนขึ้นเป็นทอด ๆ แบบต่อเนื่องเป็นปฏิกิริยาลูกโซ่ ซึ่งจะทำให้สารต่าง ๆ ในเซลล์ถูกทำลายและ เซลล์เกิดความเสียหาย เรียกภาวะนี้ว่า ภาวะ Oxidative stress อย่างไรก็ตาม โดยปรกติแล้วภายในเซลล์จะมี สารต้านอนุมูลอิสระ (anti-oxidant) ที่จะทำหน้าที่ให้อิเล็คตรอนแก่ อนุมูลอิสระโดยที่ตัวของมันเองไม่เสียความเสถียรไป ซึ่งเป็นปัจจัยสำคัญในการหยุดปฏิกิริยาลูกโซ่ ความไม่สัมพันธ์กันระหว่างปริมาณอนุมูลอิสระและสารต้านอนุมูลอิสระทำให้เกิดมีความสำคัญต่อการเกิดภาวะ Oxidative stress ขึ้น (Saretzki, G. et.al. 2002)
อนุมูลอิสระถือเป็นปัจจัยสำคัญอย่างหนึ่งที่มีผลต่อความยาวเทโลเมียร์ จากการศึกษาพบว่าในเซลล์ที่มีปริมาณอนุมูลอิสระที่สูง จะพบอัตราการหดสั้นของเทโลเมียร์ที่เร็วกว่าเซลล์ปรกติ หรืออาจหมายถึงการที่ทำงานอย่างไม่มีประสิทธิภาพของสารต้านอนุมูลอิสระ ซึ่งการหดสั้นของเทโลเมียร์ในลักษณะนี้จะเกิดขึ้นในอัตราที่เร็วกว่าการหดสั้นที่เกิดจากปัญหา “End of replication” มาก โดยลำดับเบส GGG ของเทโลเมียร์เป็นโครงสร้างที่มีความอ่อนไหวต่อ Oxidative stress, Alkylation หรือ รังสียูวี ที่ทำให้โครงสร้างของดีเอ็นเอเกิดความเสียหาย โดยภายใต้ภาวะ Oxidative stress จะกระตุ้นให้เกิดการขาดทั้งสองสายของเทโลเมียร์ที่ความถี่สูงขึ้น นอกจากนี้ยังพบว่าภาวะ Oxidative stress แบบเรื้อรังเป็นสาเหตุให้เกิดโรคที่เกี่ยวกับการติดเชื้อ (Inflammatory disease) และยังพบว่าผู้ที่เป็นโรคเรื้อรังเช่น โรคหลอดเลือดหัวใจ เบาหวานชนิด 2 และโรคปอดอุดกั้นเรื้อรัง ส่วนใหญ่จะมีความยาวเทโลเมียร์ที่สั้นกว่ากลุ่มมคนปรกติอีกด้วย (de Vos-Houben J. M. et.al. 2002, von Zglinicki, T. 2002)
จากรายงานการวิจัยพบว่าภาวะ Oxidative stress และภาวะอักเสบแบบเรื้อรัง (Chronic inflammation) ก่อให้เกิดการหดสั้นลงของเทโลเมียร์ และเป็นที่ทราบว่าสารอาหารรอง (Micronutrients) ตัวอย่างเช่น สารต้านอนุมูลอิสระจำพวกวิตามิน หรือแร่ธาตุสามารถยับยั้งสภาวะ Oxidative stress และภาวะอักเสบแบบเรื้อรัง ดังนั้นการได้รับสารอาหารดังกล่าวน่าจะมีส่วนช่วยในการชะลอการสั้นลงของเทโลเมียร์ โดยวิตามินรวม (Multivitamin) นั้นประกอบไปด้วยวิตามินหลายชนิดรวมทั้งแร่ธาตุที่เป็นแหล่งสารอาหารรองที่ดีในการเลือกรับประทาน ได้มีงานวิจัยศึกษาการรับประทานวิตามินรวมที่มีผลต่อความยาวเทโลเมียร์ในกลุ่มประชากรหญิงพบว่ามีความสัมพันธ์กับความยาวเทโลเมียร์ที่สูงกว่าในกลุ่มที่ได้รับวิตามินรวมเปรียบเทียบกับกลุ่มควบคุม โดยสารอาหารและสารต้านอนุมูลอิสระที่มีรายงานว่ามีความสัมพันธ์กับเทโลเมียร์ เช่น โฟเลต วิตามินบี 12 วิตามินเอ วิตามินดี Nicotimamide วิตามินซีและอี Omega-3 โดยการรับสารอาหารกลุ่มนี้อย่างพอเพียงจะสามารถรักษาความยาวของเทโลเมียร์ได้
ในปัจจุบันเป็นที่รู้ว่าการหดสั้นลงของเทโลเมียร์มีความสัมพันธ์กับการแก่ตัวของเซลล์ (Cellular aging) โดยความยาวของเทโลเมียร์เมื่อแรกคลอดจะมีความยาวอยู่ที่ประมาณ 10,000 bp และหดสั้นลงเรื่อย ๆ เมื่ออายุเพิ่มมากขึ้น พบว่าความยาวเฉลี่ยของเทโลเมียร์ของเซลล์เม็ดเลือดขาวมีความสัมพันธ์กับโรคที่มีความเกี่ยวข้องกับผู้สูงอายุ เช่น Atherosclerosis, Myocardial infarction, Alzheimer’s disease ความดันโลหิตสูง และ ความเสี่ยงในการเกิดโรคเบาหวาน ในตัวอย่างเช่นกลุ่มผู้ที่มีอายุมากกว่า 100 ปี (Centenarian) จะพบความยาวเฉลี่ยของเทโลเมียร์สูงกว่าค่าที่คาดไว้ และในกลุ่มที่มีสุขภาพดีจะมีค่าความยาวเฉลี่ยของเทโลเมียร์ที่ยาวกว่ากลุ่มที่มีโรคต่าง ๆ ที่เกี่ยวข้องกับความชรา นอกจากนั้นในผู้ที่มีความยาวเฉลี่ยของเทโลเมียร์จากเซลล์เม็ดเลือดขาวสั้นนั้น จะเพิ่มความเสี่ยงในการเป็นโรคมะเร็งมากขึ้น และยังพบว่าอัตราการตายที่เกิดจากมะเร็งในผู้ที่มีความยาวเฉลี่ยของเทโลเมียร์สั้นนั้นสูงกว่ากลุ่มที่มีเทโลเมียร์ยาวกว่าอย่างมีนัยยะสำคัญ ปัจจัยในการใช้ชีวิตหลายปัจจัยก็มีส่วนในการหดสั้นลงของเทโลเมียร์ ทำให้มีการศึกษาอายุทางชีวภาพซึ่งอาจมีความสำคัญในการแสดงถึงความเสี่ยงทางด้านสุขภาพในรายบุคคล ซึ่งก่อนหน้านี้อาศัยความสัมพันธ์กับอายุตามปีปฏิทิน จากความยาวของเทโลเมียร์ที่แสดงถึงความสัมพันธ์ทั้งทางตรงและทางอ้อมต่อพฤติกรรมการใช้ชีวิต หรือ สภาวะสุขภาพ ทำให้ความยาวของเทโลเมียร์น่าจะมีความสามารถในการทำหน้าที่เหมือนตัวบ่งชี้ทางชีวภาพ (Biomarker) ที่จะช่วยในการประเมินความเสี่ยงทางด้านสุขภาพ (Lapham K. et.al. 2015, Lin J. et.al. 2012, Sanders J.L. et.al. 2013) ดังนั้นเพื่อติดตามความเปลี่ยนแปลงความยาวของเทโลเมียร์ควรตรวจประจำปีละครั้ง ในการดูอัตราการสั้นลงของเทโลเมียร์ เพื่อเป็นแนวทางการรักษาที่เหมาะสม ในการชะลอ และป้องกันการหดสั้นลงของเทโลเมียร์ได้อย่างมีประสิทธิภาพ เช่นการปรับเปลี่ยนพฤติกรรมการนอน การออกกำลังกาย การรักษาระดับความเครียด รวมถึงการรับสารอาหารต่างๆ อีกด้วย
เอกสารอ้างอิง
Blackburn, E. H. “Telomeres and Telomerase: The Means to the End (Nobel Lecture).” Angew Chem Int Ed Engl 49, no. 41 (Oct 04 2010): 7405-21.
de Vos-Houben, J. M., N. R. Ottenheim, A. Kafatos, B. Buijsse, G. J. Hageman, D. Kromhout, and E. J. Giltay. “Telomere Length, Oxidative Stress, and Antioxidant Status in Elderly Men in Zutphen and Crete.” Mech Ageing Dev 133, no. 6 (Jun 2012): 373-7.
Lapham, K., M. N. Kvale, J. Lin, S. Connell, L. A. Croen, B. P. Dispensa, L. Fang, et al. “Automated Assay of Telomere Length Measurement and Informatics for 100,000 Subjects in the Genetic Epidemiology Research on Adult Health and Aging (Gera) Cohort.” Genetics 200, no. 4 (Aug 2015): 1061-72.
Lin, J., E. Epel, and E. Blackburn. “Telomeres and Lifestyle Factors: Roles in Cellular Aging.” Mutat Res 730, no. 1-2 (Feb 01 2012): 85-9.
